 COVID-19 hastalığına sebep olan SARS-CoV-2 koronavirüsü ve SARS’a sebep olan SARS-CoV koronavirüsü yakından ilişkili olan beta-koronavirüslerdir. Her iki virüs de hücrelere giriş için hücrelerimizin yüzeyinde bulunan ve aynı zamanda enzimatik bir özelliği olan “anjiyotensin dönüştürücü enzim reseptörünü (ACE-2)” kullanır.
COVID-19 hastalığına sebep olan SARS-CoV-2 koronavirüsü ve SARS’a sebep olan SARS-CoV koronavirüsü yakından ilişkili olan beta-koronavirüslerdir. Her iki virüs de hücrelere giriş için hücrelerimizin yüzeyinde bulunan ve aynı zamanda enzimatik bir özelliği olan “anjiyotensin dönüştürücü enzim reseptörünü (ACE-2)” kullanır.
SARS-CoV-2’nin patogenezi ve bunun sonucunda ortaya çıkan COVID-19 hastalığı, virüse sahip bazı bireyler asemptomatik olduğundan büyük ölçüde değişir. Buna karşılık, diğerleri akut solunum sıkıntısı sendromunu (ARDS) içerebilen ciddi belirtilerden muzdariptir.

Bu reseptör, kalp ve akciğer dokularında yaygın olarak ifade edilir. Bu reseptörün aynı zamanda doğal bağışıklık hücrelerimizden monosit ve makrofajlar tarafından ifade edildiği bulunmuştur.
COVID-19 enfeksiyonunun temel özelliklerinden biri, klinik şiddet ile ilişkili olan lenfopenidir [düşük lenfosit (T ve B hücreleri) sayısı]. SARS-CoV, insan monositlerini ve dendritik (antijen sunan) hücreleri etkili bir şekilde enfekte ederken, MERS-CoV, dipeptidil peptidaz 4 (DPP4) yoluyla monositleri ve T hücrelerini enfekte eder.
SARS-CoV-2’nin dendritik hücreleri de enfekte etmesi mümkündür. T hücre ölümü ve dendritik hücre fonksiyon bozukluğuna bağlı bağışıklık yetmezliği, COVID-19’un immüno-patolojisine katkıda bulunabilir. Bununla birlikte, “lenfopeni” COVID-19 için kötü prognozun (hastalık durumu) bir biyobelirteçi değildir. Çünkü lenfopeni, aynı zamanda 2009 influenza A (H1N1, domuz gribi) pandemisinde önemli bir biyobelirteç idi.
SARS-CoV ve MERS-CoV ile enfekte hastalarda “sitokin fırtınası” diğer bir adı ile “sitokin salım sendromunun, (SSS)” morbiditenin (hastalığın) ana nedeni olduğu bulundu.
Sitokinler nelerdir?
Sitokinler, vücuttaki çeşitli hücre türleri tarafından üretilen küçük glikoproteinlerdir. Sitokinler salındıklarında, bazıları hücre proliferasyonu ve farklılaşma süreçlerinin, otokrin, parakrin ve/veya endokrin aktivitenin kontrolünü ve ayrıca immün ve inflamatuar yanıtları düzenlemeyi içeren çok çeşitli fonksiyonları destekleyebilir.
En yaygın olarak incelenen sitokinlerden bazıları interferonları (IFN’ler), interlökinleri, kemokinleri, koloni uyarıcı faktörleri (CSF’ler) ve tümör nekroz faktörünü (TNF) içerir. Bu önemli sitokinlerin her birinin spesifik eylemleri Tablo 1’de detaylandırılmıştır.
|
Sitokin |
Etki |
Türler |
|
İnterferonlar |
|
|
|
İnterlökinler |
|
|
|
Kemokinler |
|
|
|
Koloni uyarıcı faktörler (CSF’ler) |
|
|
|
Tümör nekroz faktörü (TNF) |
|
|
Tablo 1: Ana sitokin türlerinin yanı sıra bunların alt türleri ve vücuttaki birincil eylemlerine genel bir bakış.
Sitokinler
Hücreler arasında iletişimi sağlayan, bir patojene (virüs, bakteri, vs) karşı hücrlerimizi (özellklie bağışıklık hücrlerimizi) harekete geçiren ve genel olarak yine bazı bağışıklık hücrlerimiz tarafından (nötröfil, monosit, makrofajlar) salgılanan küçük proteinlerdir.
Sitokinler, Alzheimer hastalığı, romatoid artrit ve kanser gibi durumlarla bağlantılı temel hücre sinyal molekülleridir.
Sitokinlerin, tipik olarak otokrin (aynı hücrede) veya parakrin (komşu hücrede) etkisiyle bağışıklık hücrelerinin gelişimini, aktivasyonunu ve olgunlaşmasını modüle ettiği uzun zamandır bilinmektedir. Bununla birlikte, sitokinler, aynı zamanda, onları terapötik hedefleme için önemli moleküller haline getiren, birden fazla hastalık durumunda yer alır. Ayrıca yaşlanma gibi fizyolojik süreçler sitokin ifadesinin değişmesiyle ilişkilendirilirken, sitokinlerin aşırı salgılanması son zamanlarda COVID-19 pandemisi ve çeşitli immünoterapi denemeleri sırasında ölüm nedeni olarak gözlemlenmiştir.
Bazı sitokinler genel etkilidir (diğer sitokinlerle aynı işlevselliği paylaşır), diğerleri pleiotropiktir (farklı hücre tipleri üzerinde farklı etkilere sahiptir), bazıları sinerjiktir (işlevlerini uygulamak için başka sitokinlerin mevcut olmasını gerektirir) veya antagonistiktir (birbirini inhibe ederler). Sitokinler genellikle ultra düşük konsantrasyonlarda (pikomolar aralıkta) ifade edilirler, yani tespit edilmeleri için son derece hassas immünolojik testler gerektirir. Ayrıca, çoğu sitokin salgılama işleminin geçici doğası nedeniyle yarı ömürleri kısa olup olan son derece dinamiktirler ve çok lokalize hücre içi sinyal sergileyebilirler. Sitokin araştırmaları geliştikçe, araştırmacılar sitokinleri hem bireysel biyobelirteçler olarak hem de koordineli bir yanıt bağlamında karakterize etmenin önemini öğrendiler. Örneğin, IL-6’nın artık romatoid artrit dahil olmak üzere otoimmün hastalıkların gelişmesinde ve ilerlemesinde kritik bir rolü olduğu bilinmesine rağmen ve IL-2 , IL-7 ve IL-15’in tümü kanser immünoterapileri olarak terapötik potansiyel gösterdi, çoklu sitokinler arasında güçlü bir ilişki bulmak yaygındır.
Proinflamatuar (örn., IL-1β, IL-6, IL-8, IL-12, TNF-a ve interferonlar) veya anti-inflamatuar (örn., IL-4, IL-6, IL-10, IL-11, IL-13, IL-1 reseptör antagonisti ve TGF-β) sitokinler, bulaşıcı veya kronik enflamatuar hastalıkların etiyolojisini çözmeye yardımcı olabilirler. Örneğin, proinflamatuar sitokinler, COVID-19 ile ilişkili sitokin fırtınasını araştırmak için yaygın olarak kullanılmıştır. Yine de, tek bir sitokin bağlamına bağlı olarak pro-inflamatuar veya anti-inflamatuar özelliklere sahip olabilir.
Bir sitokin olan interlökin-6’nın (IL-6) ve diğer enflamatuar sitokinlerin yüksek serum konsantrasyonları, ciddi MERS-CoV enfeksiyonlarının ayırt edici özellikleridir.
SSS, COVID-19 olan hastalarda yaygındır ve bu hastaların serumunda yüksek IL-6, akut (şiddetli) solunum yetmezliği semptomları (belirtileri) (ARDS) ile ilişkilidir. Serum C-reaktif proteini (CRP) de betacoronavirüs enfeksiyonlarının önemli bir biyobelirteci olup, bunun ifadesi IL-6 tarafından düzenlenir.
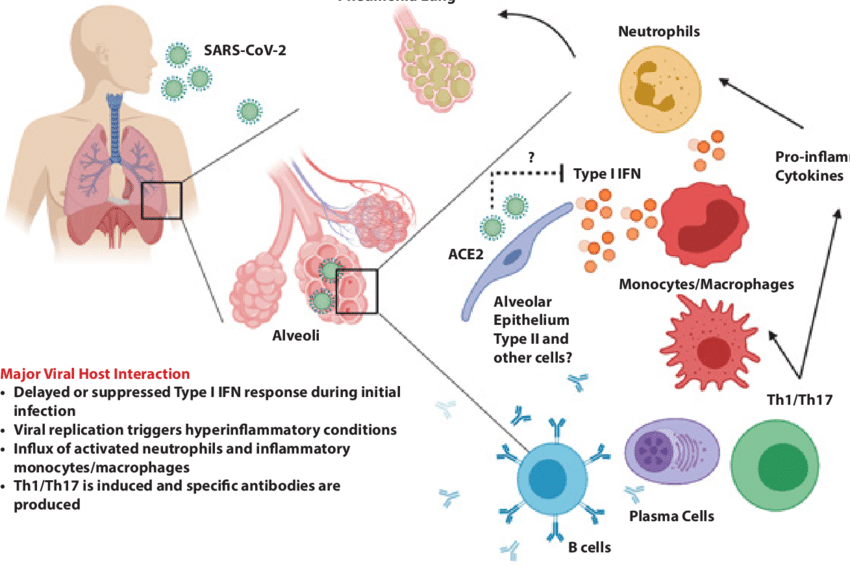
Monosit, makrofaj ve dendritik hücrelerin betakoronavirüslerle enfeksiyonu, bu bağışıklık hücrelerinde IL-6 ve diğer enflamatuar sitokinlerin ifadesi, aktivasyonu ve salgılanmasına sebep olur. IL-6, belirgin enflamatuar özelliklere sahiptir (Şekil).

IL-6, iki ana yoldan bu sinyali verebilir: birincisinde IL-6, gp130 (molekül büyüklüğü 130 kDalton olan bir glikoprotein) ile bir kompleks oluşturan membrana bağlı IL-6 reseptörüne (mIL-6R) bağlanır; bu akış aşağı sinyal iletimine JAK’lar (Janus kinazlar, substratlarına fosfat ekleyen enzimler) ve STAT3 (sinyal iletici ve transkripsiyon 3’ün aktifleştiricisi) aracılık eder. Membrana bağlı gp130 nerede ise her hücrede ifade edilirken, mIL-6R ifadesi büyük ölçüde bağışıklık hücreleriyle sınırlıdır. Bu çeşit sinyalin aktive olması, kazanılmış bağışıklık sistemi hücreleri (B ve T lenfosit hücreleri) ve doğal bağışıklık sistemi hücreleri (nötrofil, makrofaj ve doğal öldürücü (NK) hücreler] üzerinde çok yönlü etkilerle “sitokin fırtınasının” esmesine katkıda bulunur.
Sitokin fırtınasına sebep olan ikinci sinyal yolu ise, dolaşımda bulunan yüksek IL-6 konsantrasyonları, zarda sabit olmayıp eriyik halde bulunan reseptör (eIL-6R)’e bağlanması ve bu kompleksin de hemen tüm hücre yüzeylerinde bulunan gp130 dimeri ile bir kompleks oluşturmasına dayanır. Bunun sonucu, mIL-6R ifade etmeyen endotel (damarla ilgili) hücreler bile IL-6 + sIL-6R +JAK-STAT3 sinyali oluştururlar. Bu, sistemik bir “sitokin fırtınası” ile sonuçlanarak vasküler (damar) endotelyal büyüme faktörü (VEGF), monosit cezbedici protein 1 (MCP-1), IL-8 ve fazladan IL-6 salgılanmasına ve E-kaderin (hücreleri birbirine yapıştıran çok işlevli bir protein) ifadesinin azalmasına neden olur. Yüksek VEGF ve düşük E-kaderin ifadesi, damar geçirgenliğinin artmasına ve damarlardan sızmalara neden olur. Bu da, ARDS’deki pulmoner (akçiğer) işlev bozukluğuna ve düşük tansiyon patolojisine sebep olur.
Sepsis ilişkili ARDS’de sıklıkla kortikosteroidler uygulanır. Bununla birlikte, SARS ve MERS hastalarında kortikosteroid kullanımı mortalite (ölümler) üzerinde bir iyileştirme yapmadı ve hastaların virüsten temizlenmesinde gecikmeye neden oldu. Bunun sebebi, IL-6 antagonizması (inhibisyonu) ile enflamasyonun baskılandığı ve bu nesnele viral klirensin (temizlenmesinin) gecikmesi olabilir. Ancak, IL-6’i bloke temek makrofajlar tarafından salgılanan bir immünsüpresif (bağışıklık baskılayıcı) sitokin olan serum IL-10’un hızlı bir şekilde azalmasına neden olur ve bu da viral klirensin uzamasıyla ilgili endişeleri azaltabilir.
Kemokinler
Kemokinler, hücreler tarafından salgılanan küçük sitokinler veya sinyal proteinleridir. Şu anda 50 farklı kemokin rapor edilmiştir. Kanserde, bu kemokinler zaman ve mekanla değişerek farklı tipte tümör destekleyici ve anti-tümör bağışıklık hücrelerini çekebilir (“kemo” terimi zaten “kemotaksis”ten yani kimysala doğru yüzmeden gelmektedir). Bağışıklık hücrelerinin göçü ayrıca tümörlerin ilerlemesini ve metastazını ve doğrudan bağışıklık tepkisini etkiler. Kanser hücrelerinde ve immün sızan hücrelerde önemli düzenleyici işlevleri, kemokin ligandlarını ve reseptörlerini çok güçlü terapötik hedefler haline getirir:

Kaynak: Cytokine release syndrome in severe COVID-19 (John B. Moore, Carl H. June, Science 17 Apr 2020: eabb8925 DOI: 10.1126/science.abb8925) (Kısaltılıp, değiştirilerek…)
Sitokinler ve fonksiyonları: Poster


Bilgilendirme için teşekkürler
BeğenBeğen