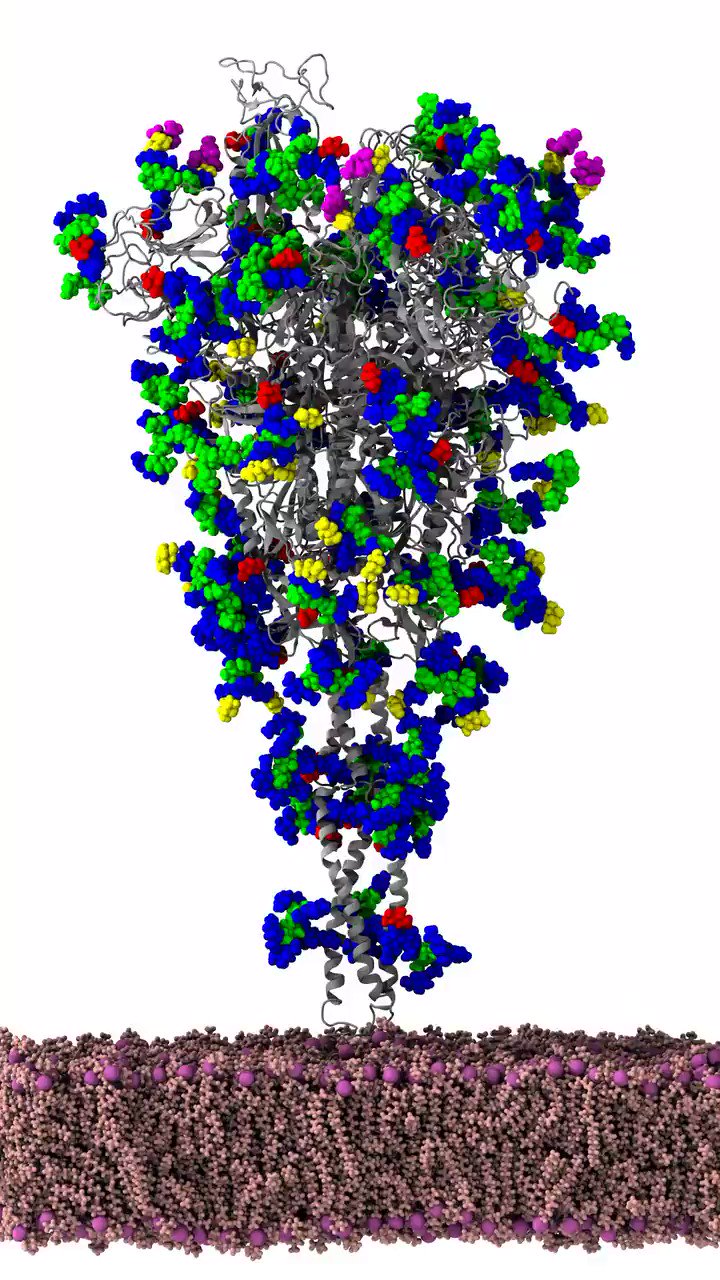
Koronavirüs lüks bir şeker kaplamaya (glikan tabakasına) sahiptir. Virüs, bu şeker katamanı ile sarılı olduğunda neredeyese tanınmaz hale gelir (yandaki şekil).
Birçok virüsün bu şekilde onların dış proteinlerini (örn. Spike) kaplayan ve onları insan bağışıklık sisteminden “koyun kılığına girmiş bir kurt” gibi kamufle eden glikanları vardır.
Ancak dikkat edilirse, proteinin tepesinden dışarı çıkan çıplak, kaplanmamış eğilmiş bir tel gibi bir yapı görülmektedir. Bu aplanmamış halka, insan hücrelerindeki reseptörlere bağlanan Spike’ın üç alt biriminin her birinin en tepesinde bulunan reseptör bağlama domeyni (alanı) (RBD)’dir.
Bu şekilde, glikanlara sahip tam uzunluktaki SARS-CoV-2 spike proteinine, küçük moleküller ve antikorlar erişmekte zorluk çekerler.
Coronavirüsler (CoV’ler), zarflı pozitif anlamlı tek zinzirli RNA virüslerinin oldukça çeşitli bir ailesidir. Çiftlik hayvanları ve evcil hayvanlar da dahil olmak üzere insanları, diğer memelileri ve kuş türlerini enfekte ederler ve bu nedenle sadece halk sağlığı için değil, aynı zamanda veterinerlik ve ekonomik bir sorundur. Nidovirales takımı ve Coronavirineae alt takımı içinde Coronaviridae ailesi yer alırlar. Bu aile Orthocoronavirinae alt ailesi içinde bulunur ve dört cinsten oluşur: alphacoronavirus, betacoronavirus, gammacoronavirus ve deltacoronavirus. Alfakoronavirüsler ve betakoronavirüsler yalnızca memeli türlerini enfekte ederken, gammakoronavirüsler ve deltakoronavirüsler kuş türlerini içeren daha geniş bir konakçı aralığına sahiptir. İnsan ve hayvan koronavirüs enfeksiyonları esas olarak solunum ve bağırsak (enterik) hastalıklarına neden olur.
HCoV-229E ve HCoV-OC43 gibi insan koronavirüslerinin toplumda dolaştıkları uzun süredir bilinmektedir. Daha yakın zamanda tanımlanan HCoV-NL63 ve HCoV-HKU1 ile birlikte bu koronavirüsler ‘soğuk algınlığı’na, yani mevsimsel ve genellikle hafif solunum yolu enfeksiyonlarına neden olurlar.
Son 20 yılda insan popülasyonunda ortaya çıkan “şiddetli akut solunum sendromu koronavirüsü (SARS-CoV)”, “Orta Doğu solunum sendromu koronavirüsü (MERS-CoV)” ve günümüzde pandemiye sebep olan SARS-CoV-2 oldukça patojeniktir. SARS-CoV, MERS-CoV ve SARS-CoV-2 enfeksiyonları insanlarda bronş epitel hücrelerini, pnömositleri ve üst solunum yolu hücrelerini enfekte ederek ciddi, yaşamı tehdit eden solunum yolu hastalıklarına sebep olabilirler.
Koronavirüs enfeksiyonunun ilk adımı, birkaç koronavirüs için tanımlanmış olan koronavirüs spike (S) proteininin ve insan aminopeptidaz N (APN; HCoV-229E), anjiyotensin dönüştürücü enzim 2‘yi içeren hücresel giriş reseptörlerine spesifik bağlanmasını içerir ( ACE2; HCoV-NL63, SARS-CoV ve SARS-CoV-2) ve dipeptidil peptidaz 4 (DPP4; MERS-CoV).

(a) Koronavirüs virionu, spike (S), zarf (E), zar (M), nükleokapsid (N) yapısal proteinlerden oluşur. Pozitif anlamlı, tek zincirli RNA genomu (+ssRNA), N tarafından kapsidlenirken, M ve E, montaj işlemi sırasında genomun viral partiküle dahil edilmesini sağlar. S trimerleri (üçlü yapıları), konakçıdan türetilen viral zarftan çıkıntı yapar ve hücresel giriş reseptörleri için özgüllük sağlar. (b) Koronavirüs partikülleri, hücresel bağlanma faktörlerine ve hücresel reseptörler (anjiyotensin dönüştürücü enzim 2 (ACE2) gibi) spesifik S etkileşimleri ile bağlanır, diğer konakçı faktörlerle (hücre yüzeyi serin proteaz TMPRSS2 gibi) birlikte viral alımı ve füzyonu teşvik eder.
Girişin ardından, gelen genomik RNA’nın serbest bırakılması ve kaplaması nın açılması, ve iki büyük açık okuma çerçevesinin (ORF1a ve ORF1b) ifadesinin gerçekleşmesi gerekir. Bunlradan elde edilen poliproteinler (pp1a ve pp1ab) viral replikasyon ve transkripsiyon kompleksini oluşturan yapısal olmayan bireysel proteinlere (nsps) işlenir. Karakteristik perinükleer çift zarlı veziküllerden (DMV’ler) oluşan viral replikasyon organellerinin biyogenezi ile uyumlu olarak, kıvrımlı zarlar (CM’ler) ve küçük açık çift zarlı kesecikler (DMS’ler), karakteristik yuvalanmış koronavirüs mRNA’ları kümesini içeren subgenomik mRNA’ların (sg mRNA’lar) viral genomik RNA replikasyonu ve transkripsiyonu için koruyucu bir mikro ortam oluşturur.
Yapılan yapısal proteinler, endoplazmik retikulum (ER) zarlarına ve oradan da ER-Golgi ara bölmesinden (ERGIC) geçerler; burada N-kapsidlenmiş, yeni üretilmiş genomik RNA ile etkileşim, salgı veziküler bölmelerin lümenine tomurcuklanma ile sonuçlanır. Son olarak, virionlar, enfekte hücreden ekzositoz yoluyla salgılanır.
Hücre içi yaşam döngüsü sırasında (bkz. yandaki Şekil), koronavirüsler yeni üretilen viral partiküllere dahil edilen tam uzunlukta genom kopyaları üretmek için genomik RNA’larını çoğaltırlar (replikasyon) ve proteinlerini ifade ederler (translasyon). Koronavirüsler, RNA sentezi için gerekli olan cis etkili ikincil RNA yapılarını içeren 5′ ve 3′ çevrilmemiş (translasyon ulmayan) bölgelerle (5′ ve 3′ UTR’lerle) çevrili oldukça büyük (yaklaşık 30 bin nükleotitlik) RNA genomlarına sahiptir. 5′ ucunda genomik RNA’nın başlığı ve 3′ yüzlerce A tekrarı olan (poliadenilat) bir kuyruğu bulunur. 5′ ucunda aynı zamanda genomun üçte ikisini kaplayan iki büyük açık okuma çerçevesine (ORF’ler; ORF1a ve ORF1b) sahiptir. ORF1a ve ORF1b, 15-16 adet yapısal olmayan proteini (nsp) kodlar; bunların 15’i, başka rollerinin yanında, RNA işleme ve RNA modifiye edici enzimleri ve proof-reading (hata okuma ve düzeltme) için gerekli işlevleri içeren viral replikasyon ve transkripsiyon kompleksini (RTC) oluşturur ve >30 kb koronavirüs genomunun bütünlüğün devam etmesinde görev alırlar. Yapısal proteinleri (S,M, E ve N) kodlayan ORF’ler ve aksesuar proteinleri kodlayan serpiştirilmiş ORF’ler, iç içe geçmiş bir alt genomik mRNA’lar (sg mRNA’lar) oluşturmak için genomun 3′ üçte birlik kısmında bulunurlar. Koronavirüs yardımcı (aksesuar) proteinleri, bireysel türler içinde bile sınırlı koruma sergileyen, oldukça değişken virüse özgü protein kümeleridir, ancak esas olarak, enfeksiyona karşı konak yanıtlarının modüle edilmesine katkıda bulundukları ve viral patojenitenin belirleyicileri oldukları düşünülmektedir. Bununla birlikte, birçok yardımcı proteinin moleküler işlevleri büyük ölçüde bilinmemektedir.
Koronavirus S proteinleri, işlevsel olarak farklı iki kısma (S1 ve S2) ayrılan homotrimerik sınıf I füzyon glikoproteinleridir (Bkz. aşağıdaki Şekil). Yüzeye maruz kalan S1, konakçı hücre reseptörüne spesifik olarak bağlanan ve böylece virüs hücresi tropizmi ve patojenitesini belirleyen reseptör bağlama alanını (Reseptör Bağlanma Domeyni, RBD) içerir. Transmembran (zara gömülü) S2 domeyni, geniş yapısal yeniden düzenlemeler üzerine viral ve hücresel zarların füzyonuna aracılık eden heptad (yedili) tekrar bölgeleri ve füzyon peptidi içerir.
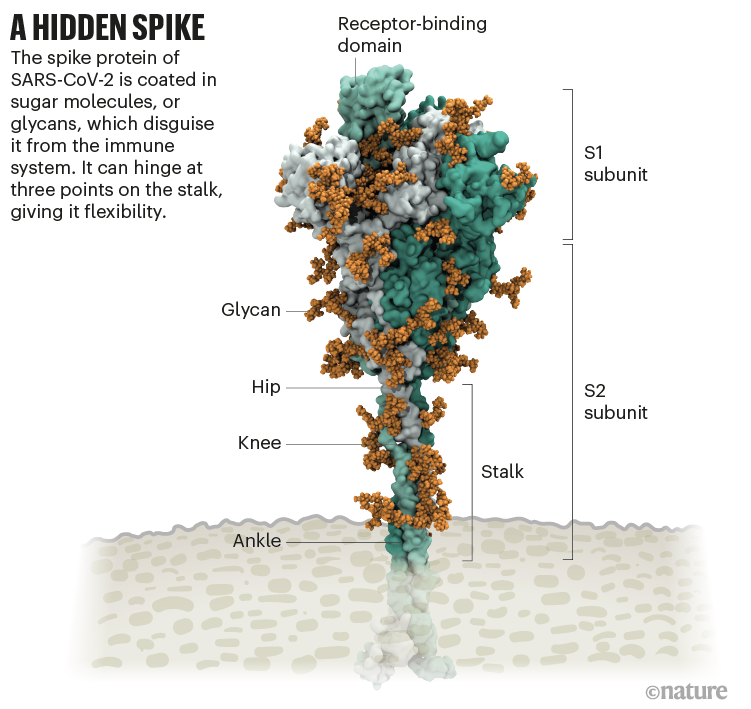
Spike’ı sıvayan bu glikanlar mutasyona uğradığında RBD aşağı çöker. Araştırmalar, iki glikanın mutasyona uğratılmasının spike proteinin bir insan hücre reseptörü bağlanma yeteneğini azalttığını gösterdi. Bu tür şekerlerin kesilmesinin virüsün bulaşıcılığını azaltabileceği düşünülüyor.
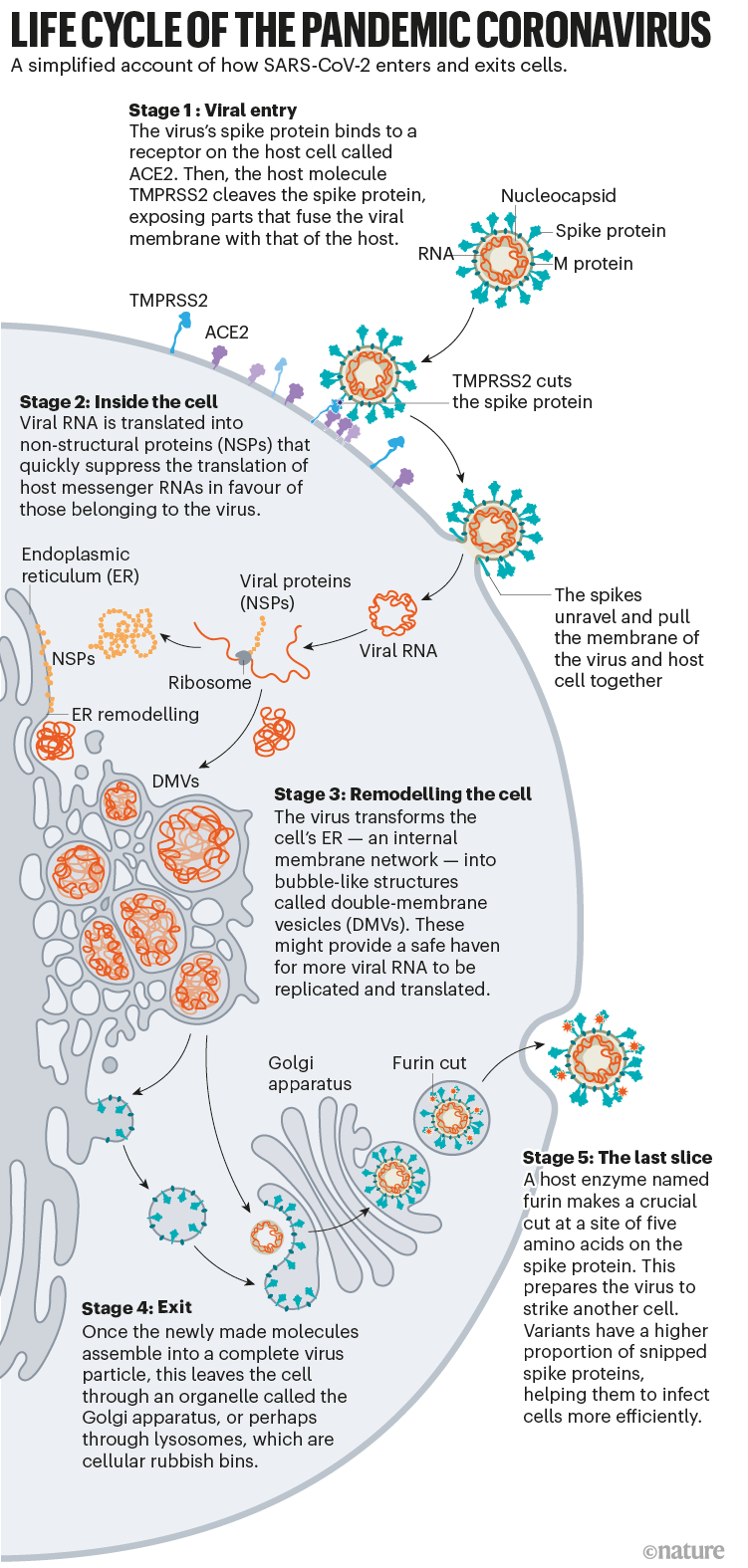
Onlarca yıllık koronavirüs araştırmaları, SARS-CoV-2’nin insan hücrelerini nasıl istila ettiğinin ayrıntılı bir açıklamasını bize sunuyor (bkz. “LIFE CYCLE OF THE PANDEMIC VIRUS”). Virüsün şaşırtıcı bir güçle insan hücrelerine tutunmasına ve ardından hücre içinde gizlenmesine yardımcı olan önemli proteinleri ve mekanizmalrı keşfetti. Bunlar, virüsün bu kadar hızlı yayılmasını ve milyonlarca cana mal olmasını sağlayan araçlardan bazıları.
kancalı ve hazır
Virüs dışardan içeriye doğru sivri uçlarla (Spike denen proteinle) başlar. Her SARS-CoV-2 virionunun (virüs partikülü), insan hücreleriyle kaynaşmanın anahtarı olan 24-40 gelişigüzel düzenlenmiş Spike proteinleriyle süslenmiş bir dış yüzeyi vardır. Grip gibi diğer virüs türleri için bu dış taraftaki füzyon (kaynaşma) proteinleri nispeten katıdır. Ancak SARS-CoV-2 sivri uçları (yani Spike) son derece esnektir ve üç noktada menteşe bulundurur.
Bu menteşeler Spike’ın sallanmasına, yüzmesine ve dönmesine izin verir; bu durum, virüsün hücre yüzeyini taramasını ve birden fazla Spike’ın bir insan hücresine bağlanmasını kolaylaştırabilir.
Pandeminin başlarında araştırmacılar, SARS-CoV-2 spike proteinlerinin RBD’lerinin, insan boğazındaki epitel hücrelerin ve akciğer hücrelerinin dışını süsleyen ACE2 reseptörü adı verilen tanıdık bir proteine bağlandığını doğruladı. Bu reseptör aynı zamanda şiddetli akut solunum sendromuna (SARS) neden olan virüs olan SARS-CoV için de kenetlenme noktasıdır. Ancak SARS-CoV ile karşılaştırıldığında, SARS-CoV-2, ACE2’ye tahmini olarak 2-4 kat daha güçlü bir şekilde bağlanır, çünkü RBD’deki çeşitli değişiklikler virüsün bağlanma noktalarını kararlı kılmıştır.
SARS-CoV-2’nin endişe verici varyantları, ACE2 reseptörüne bağlanmadan sorumlu olan spike proteinin S1 alt biriminde RBD’lerde mutasyonlara sahip olma eğilimindedir (Spike’ın diğer alt birimi olan S2, konak hücrenin zarı ile viral füzyonu harekete geçirir).
Örneğin Alpha varyantı, spike-protein dizisinde 10 değişiklik içerir ve bu da RBD’lerin ‘yukarı’ konumunda kalma olasılığının arttırır. Bu durum, virüsün hücrelere girmesini kolaylaştırır.
Delta varyantının S1 alt biriminde, çok sayıda mutasyon vardır ve RBD’sinde bulunan 3 mutasyon virüsün ACE2’ye bağlanmasını kolaylaştırıyor ve bağışıklık sisteminden kaçma yeteneği kazandırıyor.
Sınırlı giriş
Viral Spike ACE2’ye bağlandığında, konakçı hücrenin yüzeyindeki diğer proteinler, viral ve hücre zarlarının birleşmesine yol açan bir süreci başlatır (bkz. ‘VIRAL ENTRY UP CLOSE’).
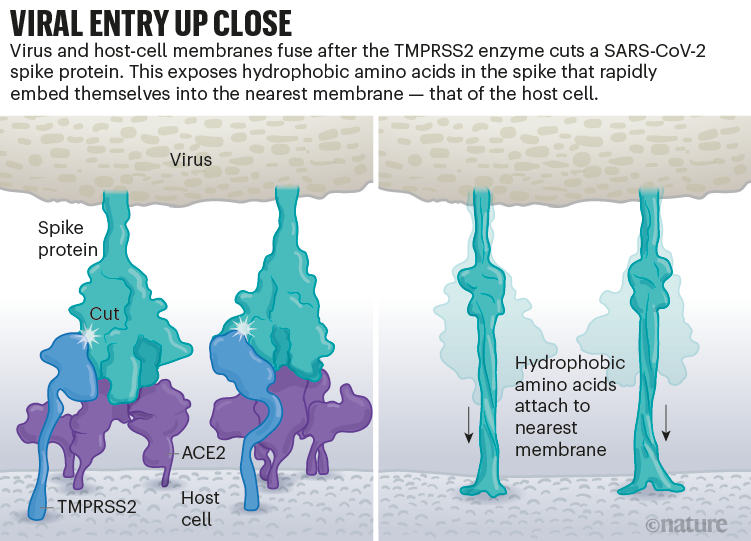
SARS’a neden olan virüs SARS-CoV, içeri girmek için iki konakçı proteaz enziminden birini kullanır: TMPRSS2 (Transmembrane serine protease 2) veya katepsin L. TMPRSS2 daha hızlı bir yol olsa da, SARS-CoV bunun yerine genellikle katepsin L’ye dayanana endozomal (hücre içinde zrla çevrili küçük baloncuklar) yolla hücreye girer. Ancak virionlar hücrelere bu yolla girdiğinde, hücrelerimizdeki antiviral proteinler (örn. interferon ve interlökinler) onları yakalayabilir.
SARS-CoV-2, solunum hücrelerinin yüzeyinde yüksek miktarlarda bulunan bir enzim olan TMPRSS2’yi verimli bir şekilde kullandığı için SARS-CoV’dan farklıdır. İlk olarak, TMPRSS2, Spike’ın S2 alt ünitesi üzerindeki bir yeri keser. Bu kesim, kendisini en yakın zara, yani konakçı hücrenin zarına hızla gömen bir dizi hidrofobik (suyu sevmeyen) amino asit açığa çıkarır. Daha sonra, uzayan Spike, bir fermuar gibi kendi üzerine kıvrılarak virüsün zarfı ile ve hücre zarının kaynaşmasını sağlar.
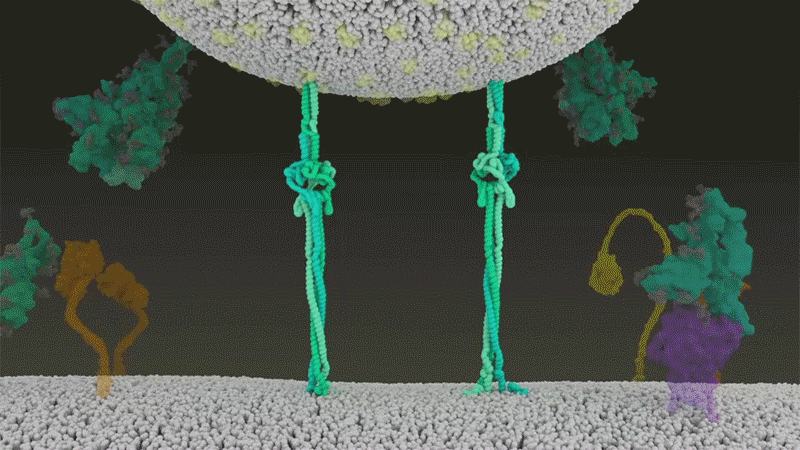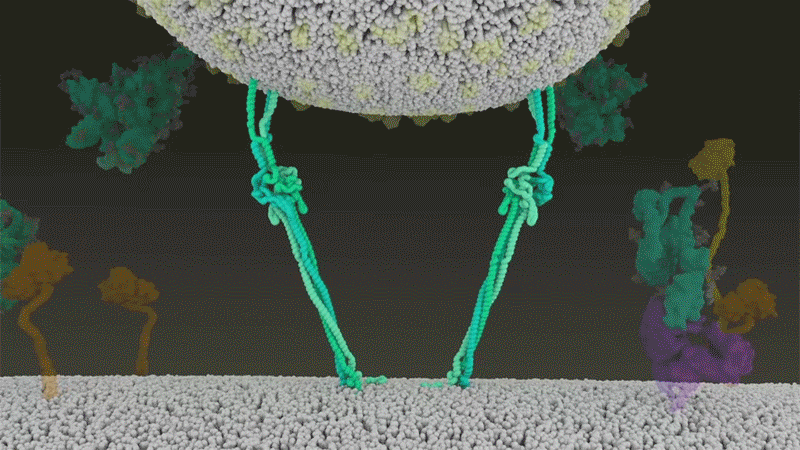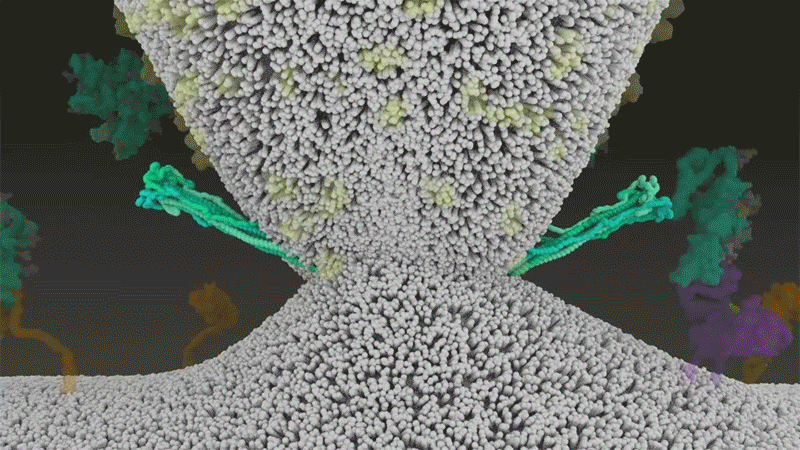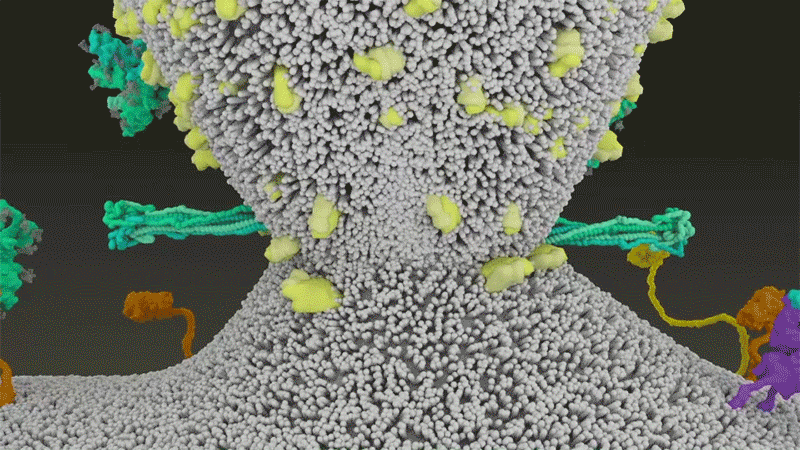
Virüs daha sonra genomunu doğrudan hücreye atar (enektördeki sınıyı boşaltmak gibi). SARS-CoV-2 bu yaylı şekilde istila ederek SARS-CoV’dan daha hızlı enfekte etmekte ve endozomlarda hapsolmaktan kaçınmaktadır .
Virüsün TMPRSS2 kullanarak hızlı girişi, laboratuvarda erken umut verici çalışmalara rağmen sıtma ilacı klorokinin klinik deneylerde COVID-19 tedavisi için neden işe yaramadığını açıklamaktadır. Klorokin, katepsinlere dayanan, endozomal yolağı giriş için kullanan virüsler için bir işe yarayabilir, ancak SARS-CoV-2 gibi alternatif yolara da başvuran bir virüs için etkili olmaz.

Ölümcül rekabet
Enfeksiyonun sonraki adımları daha karanlıktır. Virüsün hücrenin içine girdikten sonraki bilinmezler daha fazladır. Virüs, kendi RNA genomunu hücreye enjekte ettikten sonra, sitoplazmadaki ribozomlar, viral RNA’nın iki bölümünü uzun amino asit dizilerine çevirir ve bunlar daha sonra, çoğu RNA sentezinde yer alan 16 proteine bölünür. Daha sonra, Spike gibi yeni virüs parçacıklarını ve diğer yardımcı proteinleri yapmak için kullanılan yapısal olanlar da dahil olmak üzere şu ana kadar bilinen toplam 26 viral proteini kodlayan daha fazla RNA üretilir. Bu şekilde virüs, kendi mRNA’sının kopyalarını yaymaya başlar. Ancak bu mRNA’ları proteinlere çevirmek için hücrenin mekanizmasına ihtiyacı vardır. Koronavirüsler bu makineyi birçok yönden ele geçiriyor.
Birincisi, virüs rekabeti ortadan kaldırır: virüs geldiğinde çevrilen ilk proteinlerden biri olan viral protein Nsp1, viral etiketi olmayan tüm hücresel mRNA’ları sistematik olarak parçalamak için konakçı proteinleri devşirir. Bu etiket bir konakçı mRNA’nın ucuna koyduğunda, o mRNA’nın parçalanmadığı gösterilmiştir.
İkincisi, enfeksiyon, hücredeki genel protein translasyonunu (sentezini) %70 oranında azaltır. Bunda da yine suçlu yine virüsün Nsp1 proteinidir. Çünkü, bu sefer fiziksel olarak ribozomların giriş kanalını bloke eder, böylece hücresel mRNA içeri giremez ve geriye kalan düşük çeviri kapasitesi viral RNA’lara ayrılmış olur.
Sonunda virüs, hücrenin alarm sistemini kapatır. Bu çeşitli şekillerde olur: virüs, bağışıklık sistemini enfeksiyona karşı uyarması amaçlanan proteinler için talimatlar da dahil olmak üzere hücresel mRNA’nın çekirdekten çıkmasını engeller. Nsp1 proteini, çekirdekteki çıkış kanallarını sıkıştırıyor gibi görünmektedir ve bu nednle hücresel mRNA’lar bu porlardan çıkıp sitoplazmaya gelememekte ve burada içlerinde birçok alarm proroteininin de bulunduğı hücresel proteinleree çevirlememektedir.
Gen transkriptleri (yani mRNA’lar ve hatta diğer RNA’lar) çekirdekten çıkamadığı için, enfekte olmuş hücreler interferon gibi virüslere karşı çalışan ve bağışıklık sistemini bir virüsün varlığına karşı uyaran sinyal proteinleri olan etkili sitokinleri salamaz. SARS-Cov-2, bu alarm sistemini kapatmada özellikle etkilidir: SARS-CoV ve solunum sinsityal virüsü dahil olmak üzere diğer solunum yolu virüsleriyle karşılaştırıldığında, SARS-CoV-2 enfeksiyonu önemli ölçüde daha düşük interferon seviyelerine neden olur. Araştırmalar, Alpha varyantında interferon üretimini daha da etkili bir şekilde bastıransağlayan mutasyonlar bildirdiler.
Vücudun patojenlere karşı en önemli savunmalarından biri, hücrelerin bir istilacı tespit ettiklerinde ürettiği interferon adı verilen bir moleküldür. İnterferon, enfekte olmuş hücrelere, örneğin virüsleri endozomlarda hapsolmuş halde tutarak, kendi savunmalarını artırmalarını söyler. İnterferon aynı zamanda enfekte olmamış komşu hücrelere de aynısını yapabilmeleri için bir uyarı sinyali gönderir.
Dolayısı ile SARS-CoV-2, bağışıklık sistemimizin enfeksiyonu tanımasını ve ilk aşamalarda enfeksiyonla mücadele etmesini önleme konusunda benzersiz bir yeteneğe sahiptir ve hızlıca çoğalır. Bağışıklık sistemi bir virüs olduğunu anladığı zaman, o kadar çok virüs vardır ki, bağışıklık tepkisi proteinleri bazen kan dolaşımına normalden daha hızlı bir şekilde taşar (sitokin fırtınası) ve bu da hasara neden olabilir. Doktorlar pandeminin başlarında, çok hastalanan COVID-19’lu bazı kişilerin, virüsün yanı sıra SARS-CoV-2’ye karşı aşırı aktif bir bağışıklık tepkisinden zarar gördüğünü gördüler. Kanıtlanmış bazı tedaviler bu bağışıklık tepkisini azaltarak çalışır.
Yenileme istasyonu
Virüs, konak çevirisini (protein sentezini) devraldığında, hücrenin içini ve dışını ihtiyaçlarına göre kapsamlı bir şekilde yeniden şekillendirerek bir ev değişikliğine başlar.
İlk olarak, yeni yapılmış viral Spike proteinlerinin bazıları hücrenin yüzeyine gider ve konak hücre zarından dışarı sarkar. Orada, konakçının yine zrda bulunan bir kalsiyum iyon kanalını aktive eder. Normalde bu kanal kas kasılmasında ve sinir iletiminde de rolü olan kalsiyumu dışarı atmada kullanılır. Bu noktada, enfekte olmuş hücre, ACE2 ifade eden komşu hücrelerle kaynaşır ve 20 kadar çekirdeği olan büyük bireysel solunum hücrelerine dönüşür.
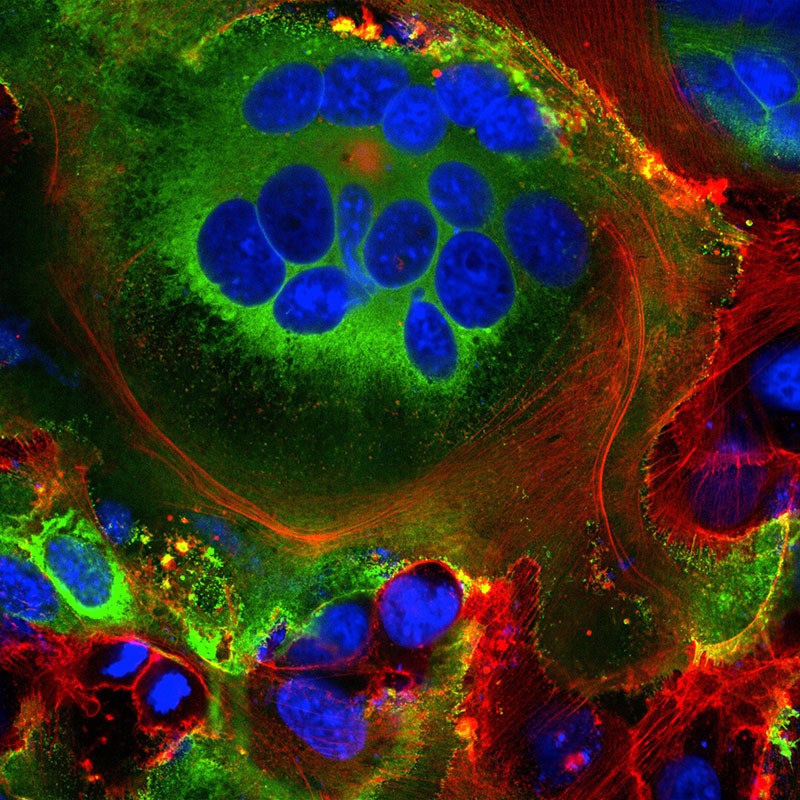
Son çalışmalar, sinsitiya adı verilen bu kaynaşmış yapıların HIV ve herpes simpleks (uçuk) virüsü gibi viral enfeksiyonlar tarafından indüklendiğini, ancak SARS virüsü tarafından tetiklenmediği düşünülüyor. Sinsitiya oluşturmanın, enfekte olmuş hücrelerin uzun süreler boyunca gelişmesine ve daha fazla virion üretmesine izin verdiği varsayılıyor. Ancak, başka bir çalışma, COVID-19 ile enfekte olmuş bazı hücrelerin, vücudun kendi bağışıklık hücrelerinden biri olan lenfositlerle sinsitiya oluşturduğunu rapor etti. Bu durum, tümör hücreleri tarafından bilinen bağışıklık kaçırma mekanizmasıdır, ancak virüsler tarafından değil. Enfekte olmuş hücrelerin, yakındaki bağışıklık gözcülerine tutunarak ve onlarla birleşerek bağışıklık tespitinden kaçındığı düşünülmekte.
SARS-CoV-2 ile enfekte olan hücrenin içinde daha da fazla değişiklik meydana geliyor gibi görünmektedir. Diğer koronavirüsler gibi, SARS-CoV-2 de protein sentezi, taşınma ve tasnifinde yer alan düz zarlardan oluşan bir ağ olan uzun, ince endoplazmik retikulumu (ER) sanki üflenmiş gibi çift zarlı kürelere (baloncuklara) dönüştürür. Bu çift zarlı kesecikler (duble membran vezikülleri, DMV’ler), viral RNA’nın kopyalanması ve proteine çevrilmesi (translasyon) için güvenli bir yer sağlayabilir ve onu hücredeki doğuştan gelen bağışıklık sensörlerinden koruyor olabilir. Ancak bu hipotez hala doğrulanmamıştır.
DMV’lerin yapımında yer alan proteinler, viral replikasyon için gerekli göründükleri için iyi ilaç hedefleri olabilir. Örneğin, TMEM41B bir konakçı (yani bizim) proteindir. ER zarlarını genişletmek için kolesterol ve diğer lipidleri harekete geçirmek için gerekir. Böylece tüm virüs parçaları bu genişlemiş zarın içine sığar. TMEM41B çıkarıldığında bunun enfeksiyon üzerinde büyük bir etkisinin olduğu gösterilmiştir. var” diyor. Koronavirüs transmembran proteini Nsp3 de bir hedef olabilir: yeni yapılmış viral RNA’ yı dışarı atmak için DMV’lerin duvarlarında taç benzeri bir gözenekler oluşturur .
Çoğu virüsün “zarf” (envelope) olarak bilinen bir dış ambalajı vardır. Bu özellik sayesinde, hücrenin kendi plazma zarının bir kısmını seçerek doğrudan hücre zarı ile bir araya gelebilirler. Ancak yeni yapılan koronavirüs proteinleri farklı bir yol izler.
Yıllardır biriken kanıtlar, koronavirüslerin hücreden bir postane gibi çalışan Golgi kompleksi aracılığıyla, molekülleri zarlarda paketleyen ve onları hücrenin diğer bölümlerine gönderen organellerle taşındığını ileri sürdü. Bu organelde virüs, kompleksin zarından bir lipid zarfı oluşturur; yeni oluşan virionların daha sonra Golgi veziküllerinin (kesecikleri) içinde hücre yüzeyine yüzeyine taşındığı düşünülmektedir.
Ancak, hücreyi parçalayan enzimlerle dolu hücresel mideler olan lizozomlar aracılığıyla da koronavirüslerin hücreyi terk edebilecekleri düşünülmektedir. Buna kanıt olarak, Golgi tabanlı salgı yolağının bloke edilmesinin, salınan bulaşıcı virüs miktarını etkilemediği gösteriliyor. Muhtemelen, viral proteinler ER’da tomurcuklanarak bir zarf kazanmakta ve ardından hücreden çıkmak için lizozomlar kullanılmaktdır. Dolayısı ile, potansiyel antiviral adaylar olarak lizozomal çıkış sürecini bloke eden inhibitörler test edilmelidir.
Bir hücreyi Golgi veya lizozomlardan terk etmek, bir plazma zarından tomurcuklanmaya kıyasla yavaş ve verimsizdir. Bu nedenle bilim insanlrı SARS-CoV-2’nin bunu neden yaptığını henüz bilmiyorlar. Golgi’den veya lizozomdan türetilen bir zarfın lipid (yağ) bileşiminin, virüs için plazma zarındakinden bir şekilde daha faydalı olduğundan şüpheleniliyor.
Son dilim
Hücreden çıkarken, bir olay daha bu virüsü bulaşıcı ve yıkıcı yapar: beş amino asitlik bir bölgede hızlı bir kesme, virüsü bir sonraki hedefini vurmaya hazırlar.
Diğer koronavirüslerin Spike’ı S1 ve S2 alt birimlerinin birleşme noktasında tek bir arjinin amino asidine sahipken, SARS-CoV-2 beş amino asitlik bir diziye sahiptir: prolin, arginin, arginin, alanin ve arginin (Furin kesme bölgesi). Bu bölgenin akciğer hücrelerinin istilası için gerekli olduğu ortaya çıktı. Furin adı verilen bir konakçı hücre proteini bu amino asit dizisini tanır ve ortadan keser. Bu işlem (kesilme) virüsün insan akciğer hücrelerine verimli bir şekilde girmesi için “gerekli” olduğu bulunbmuştur.
Bir virüs üzerinde bir furin bölünme (ya da kesilme) bölgesi tespit edilmesi ilk kez olmuyor; son derece patojenik kuş gribi virüslerinde de bu bölge var. Kültür hücrlerine furin bölgesini kendiliğinden kaybetmiş bir SARS-CoV-2 suşu gönderildiğinde, bu suşla enfekte olan yaban gelinciğinin, pandemik suşla enfekte olanlardan daha düşük miktarlarda viral partiküller saçtığı bulunmuştur.
Furin enziminin bu bölgeyi virion montajı sırasında veya serbest bırakılmadan hemen önce kestiğinden şüpheleniliyor. Zamanlama virüsün neden Golgi veya lizozomlardan çıktığını açıklayamaktadır: virüs partikülleri monte edildiğine, furin proteaz varlığında işlenebilecekleri bir organele girerler.
Furin kesimi, S1 ve S2 alt birimleri arasındaki bağı kopararak, virion Spike proteinlerini gevşetir, böylece hücre girişi sırasında TMPRSS2 tarafından ikinci bir kesime yanıt verir. Bu durum, hidrofobik domeyni açığa çıkarır ve bu da bir konakçı hücre zarına hızla gömülmeyi sağlar. Spike, furin tarafından önceden kırpılmazsa, virüsler TMPRSS2’yi baypas ederler ve daha yavaş endozomal yoldan girerler.
İki koronavirüs varyantında (Alpha ve Delta) furin bölünme bölgeleri değişime uğradı. Alfa varyantında, ilk prolin (P) amino asidi bir histidine (P681H) değişt; Delta varyantında ise bu amino asit (P) bir arjinin (P681R) olarak değişti. Her iki değişiklik de diziyi daha az asidik hale getirdi. Dolayısı ile amino asit dizisi ne kadar basitse, furin onu o kadar etkili bir şekilde tanır ve keser. Daha fazla furin kesimi, insan hücrelerine girmeye hazırlanan daha fazla Spike proteini anlamına gelir.
Bilinen bilinmeyenler
Bilim topluluğu hala yüzeysel bir SARS-CoV-2 bilgisine sahip. Önemli bilinmeyenler arasında, her bir spike proteine bağlanmak için gereken ACE2 reseptörlerinin sayısı; S2 bölgesi TMPRSS2 tarafından tam olarak ne zman bölündüğü; ve virüs-hücre zarı füzyonu için gereken Spike sayısı. kaldı ki bunların hepsi sadece virüsün hücreye tutunması ve girişi ile ilgili olanlar. Yapılan bir çalışma SARS-CoV-2 ile insan proteinleri arasında en az 332 etkileşim tespit etti.
Hızla mutasyona uğrayan virüse ayak uydurmak kolay değil. Uzmanlar, şimdiye kadarki çoğu mutasyonun, virüsün konakçıya ne kadar zarar verdiğiyle değil, virüsün ne kadar etkili yayıldığıyla ilişkili olduğu konusunda oldu.

- How the coronavirus infects cells — and why Delta is so dangerous
- Coronavirus biology and replication: implications for SARS-CoV-2

